CzeekV Pro 機能紹介 データについて
-
CzeekV Proに搭載しているデータについて紹介します。
本システムには日米の有害事象自発報告データベースを搭載しています。1.FAERS
FDAが公開している自発報告有害事象データベースです。
FDA Adverse Event Reporting System の略です。
歴史を語れば長いのですが、報告者には患者等、非医療従事者を含んでおり、それがゆえに膨大なデータを集積出来ていることが特徴的です。
反面、薬剤や症状の記載ミス・データの欠如など解析に影響がある症例レポートも多く含まれています。
また、同じ患者さんの情報を医療機関だけでなく、製薬企業からも報告されていたりと重複データが存在します。(約2割ほど)
したがって生データがすぐに解析用に活用できるデータではないため
FAERSの解析前にはデータのクレンジング、キュレーションが重要になってきます。1997年に一度大改編を行い、現状に近いフィールド・データ構造を整備しました。
2014年第3期(公開データから)にも手を加えており、症例レポート識別番号(ISR)も大きく変わっています。
これにより重複削除の対象がより分かりやすくなっています。
近年注目を浴びているDOSE(容量)を注目した解析にも対応できるように
単位や用量なども記載がきれいになっている傾向がありますが、全体としては欠如が多いです。投与時から有害事象発生日を計算して、有害事象発生期間を解析対象とする研究報告も
増えてきましたが、この計算をするためにもきちんと8桁(YYYY,MM,DD)の記載が求められますが、
残念ながらこの記載も欠如が多いです。とはいえ、不均衡シグナル指標を用いて薬剤と関係する有害事象を探索するには大規模なデータが必要という視点でみると
多くのデータを有している(1000万件を超えています)点は他と比較しても手に入りやすい中では優位なデータと言えるのではないでしょうか。一言で言ってしまうと「大規模ゆえにデータがきれいでは無い」というデータベースです。
その原因を国民性に求めるのはどうかと思いますが、これだけのボリュームを集積しているのは決断力、実行力ともに感服です。解析実施時にはキュレーションから慎重に進めることは非常に重要であると言えます。とはいえ、英語ですので薬剤辞書やMedDRA他コーディングには一苦労するかと思います。手前味噌ですが、CzeekV Proもその点に腐心してきました。更新タイミングは四半期に一度で追加データ分だけが公開されます。
だいたい3月・6月・9月・12月の中旬〜上旬に公開されます。たまに遅れますが、そこはご愛嬌でしょう。
RSSでWhat'sNewをウォッチしていますが、そこに記載がないまま最新情報が該当ページに公開されていることもあるので要注意です。
我々も常に最新版の公開には目を向けていますので、公開を発見した時にはFACEBOOK,Twitterにてお知らせします。
お知らせが遅くなれば申し訳ございません。FDAは自ら本データを用いたシグナル解析を公開しており、HP上でリスクを警告しています。直リンクは避けますが「Potential Signals of Serious Risks」でFDAのHP内を探してもらえるとすぐに見つかると思います。
英語だと解釈が難しいという方は、日本語でこの内容をお知らせしてくれる機関、ページをオススメします。
気になる方は問合せにてご要請ください。本サイトで紹介していいものかどうか分かりかねますので。2.JADER
PMDAが公開している「副作用が疑われる症例報告に関する情報『医薬品副作用データベース』」です。
Japanese Adverse Drug Event Report database の略です。製薬企業、医療機関からの副作用情報報告をもとにPMDAにて整理されたデータベースです。
主に重篤な副作用が報告されており、多く収載されている点が特徴的です。
したがってどうしても偏りが存在することは否めません。同時に報告される副作用にも影響しますので、
注目薬剤の解析をする際には感覚とは違った結果が出る可能性もあるかもしれません。
この点解析を進めるにあたって、こちらもデータベースの特徴・特性を掴んでおく必要があるかと思います。今後、薬剤師さんや医師との共同研究や分析で医療従事者としての肌感覚を教えてもらえれば
本サイトでも発信していきたいと考えています。更新は毎月中旬頃です。大型連休がある月は中旬前には公開されています。
上から目線ではないですが、流石ですね。
お陰様で我々もダウンロードしてから安心して休みに入れます。
こちらはFDAと違って、全データを更新して公開しています。また、データ記載内容ですが、欠如データも少なく解析は比較的しやすいのではないかと思います。
ただし、重複データが無いわけではありません。
患者情報(demoデータ)をもとに同一人物と定義する手法も無くはないですが、
解析する際にその点は注意したほうがよいかと思われます。個人的には薬剤連番001のものは製品名も記載があることからジェネリックとの比較などができれば面白いのではと昔から考えていますが、有意な差が出るかどうかはやってみないと全くわかりません。差がないという結果も有用だと思います。解析にあたっての課題、注意点ももちろんあるかと思いますので、医療現場のメンバーと相談しながら注目してみたいと思います。
この話は横道ですので本筋に戻ります。
他にもデータの記載内容がちょくちょく変わりますのでその点も注意です。
公開当初は医療機関が病院と薬局に分かれていたりと詳細な区別がありましたが
現在は医療機関という一括りにまとめられています。
最近ですと、第1被疑薬、第2被疑薬という定義がなくなり、被疑薬という括りにまとめられました。
(しかし薬剤連番はついたままですので、今のところCzeekV Proでは、連番001を第1被疑薬として解析結果を検索できるようにしています。)
報告日も8桁記載だったものが12桁まで増えています。時間と分が追加されています。YYYY,MM,DD,HH,mmという並びのようです。
Weibull解析など副作用解析をされたい場合はこういった細かい変化にも注意しておいたほうが良いかと思います。いずれも継続的なデータ分析をする場合の”あるある”かもしれません。
経験者は毎回ReadMeや、データ情報のビフォー・アフターの違いをチェックしているかと思います。
我々も”てにをは”まで変化を確認しています。結構文章や表現が変わっていて面白いです。
PMDA職員の方のきめ細やかさが分かり、感服しております。
倣って、このブログも都度文章の推敲を進めていきたいと思っています。その他、各データベース(DBと今後は書くこともあります)の特徴については
各研究会や有識者の方々が報告していますので情報をつかめば追記や、独立した投稿で発信していきたいと思います。下記比較表参考までに(2017年2月末現在のデータです)
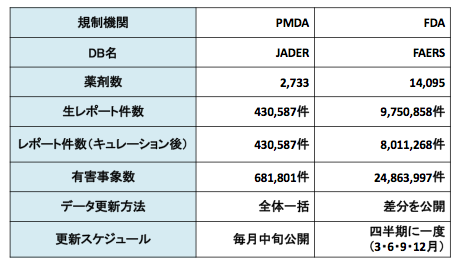
上の表にはありませんが、比較するとやはり報告有害事象の多様性に違いがはっきり出ています。
有害事象報告にはMedDRA用語が用いられますが、PT22,499語のうち、
FAERSは18,194語、JADERは8,024語と バリエーションの差が顕著です。(2017年6月1日時点)
分母が小さいからという要因はもちろんあるでしょうが、
添付文書によく記載があるような重篤な有害事象が重視されている背景があるかと思います。
日本の報告のほうが間質性肺疾患が多い所以かもしれません。そうした傾向に対してSMQなどの階層を用いて解析を進めようという研究報告もありますが
それについては別の機会にて投稿したいと思います。その他下記もご参考頂ければ幸いです。最新版データで公開しています。
レポートデータについて
(CzeekV Proサイト) -
お問合わせ
メルマガ登録




