DB構造について JADER版
-
前回に引き続き、DB構造について説明します。 今回は医療データベースとして、JADERの中身をより詳細に紐解きながら説明します。 後半ではFAERSとの違いなども説明したいと思います。
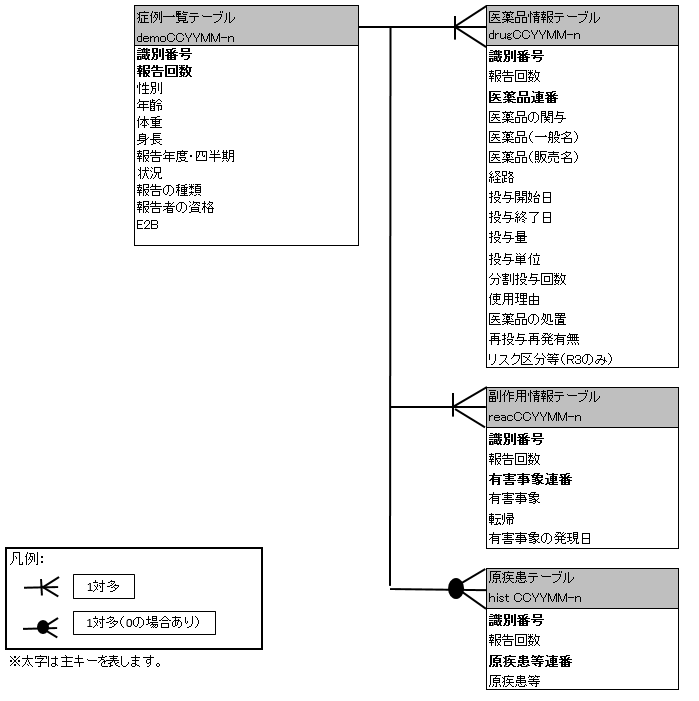
右図はJADERのダウンロードサイトでも確認できるデータベースのER図になります。
テーブル間の関連性がひと目で分かる図です。(出典:PMDA)
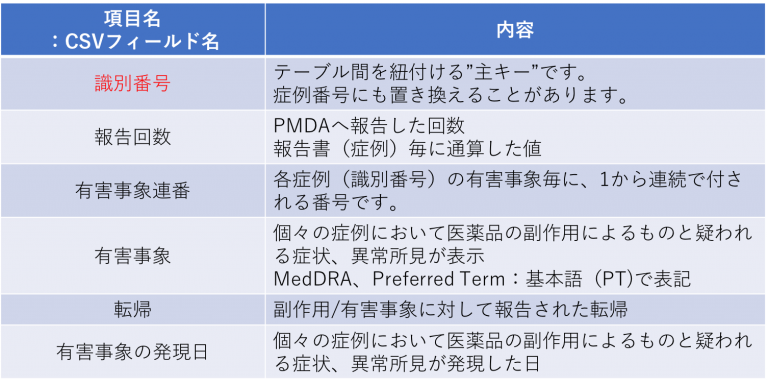
識別番号とあるものが「主キー」となるもので、この番号で各テーブルを紐付けます。
詳細は割愛しますが国際標準であるICHガイドライン「個別症例安全性報告を伝送するためのデータ項目」が新しい方式E2B(R3)となったこともあり、2016年第1期以降には項目や記載内容に混在が見受けられます。
FAERS同様、DB構造・記載内容の変更には注意しておいたほうが良いでしょう。各テーブルについて詳細説明します。
(1)症例一覧テーブル Demoテーブルについて
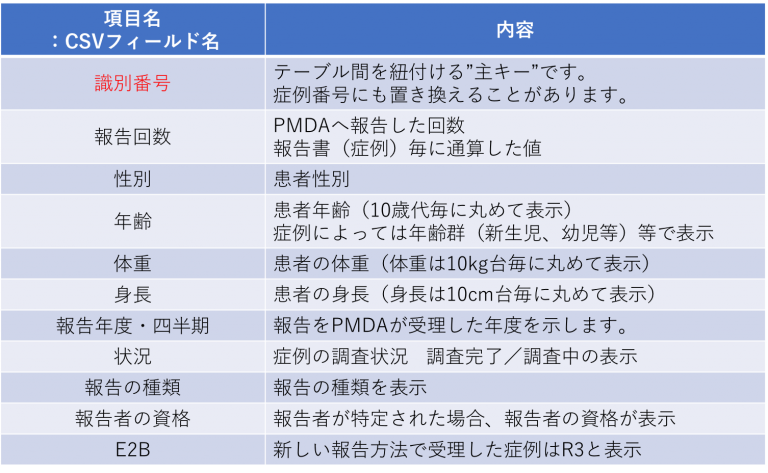
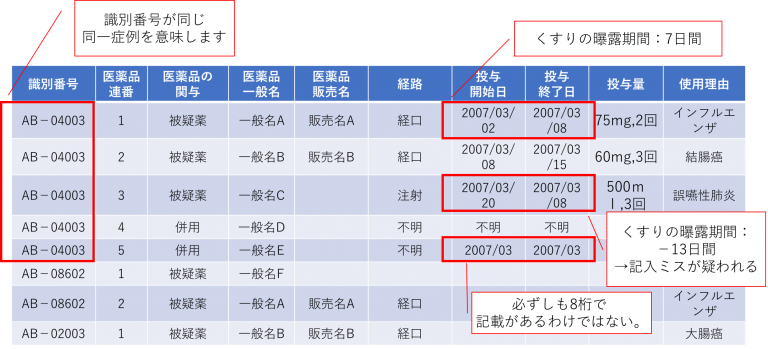
「識別番号」には頭文字に英文字がついています。
ABは製薬企業からの国内副作用報告を示します。
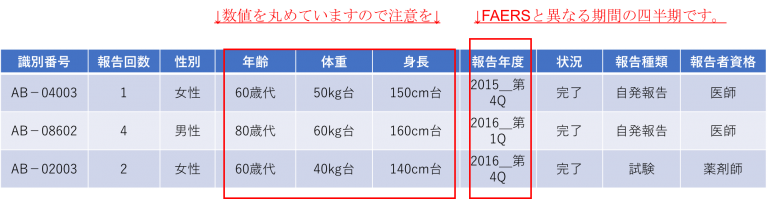
CA又はCBとなっている報告は、医療機関等からの国内副作用報告のうち、PMDAが調査を実施した報告です。以前はこれがQ:病院、R:薬局 と区別されていましたが、現状最新版では、「CAとCB、QとRは特に区別していただく必要はございません。」との注意書きがついています。◆「年齢・身長・体重」は丸めて表示されています。患者のプライバシーへの配慮のためです。
◆「報告の種類」に表示される用語と説明は以下となります。
自発報告 :症例が自発的観察からのものである場合
試験 :症例が試験から生じたものである場合
その他 :上記の何れでもない場合
不明 :報告の種類について情報がない場合◆「報告者の資格」に表示される用語と内容は以下となります。
医師 : 医師、歯科医師の場合
薬剤師 : 薬剤師の場合
医療関係者 : その他の医療専門家の場合
弁護士 : 弁護士の場合
消費者等 : 消費者又はその他の非医療専門家の場合症例テーブル サンプル
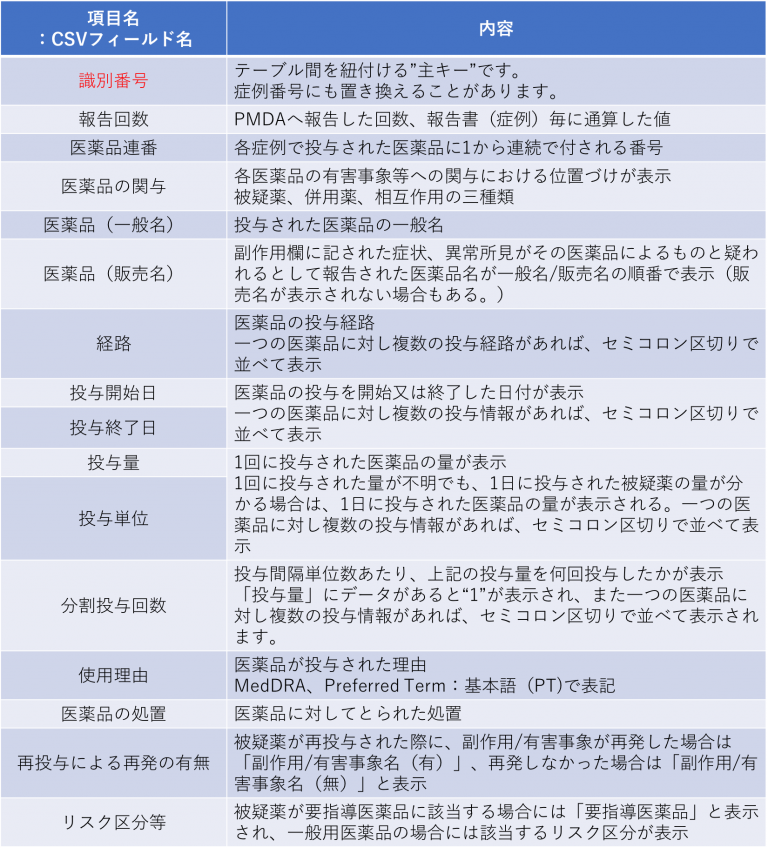
(2)医薬品情報テーブル Drugテーブルについて
「医薬品の関与」には、報告された各医薬品の有害事象等への関与における位置づけが表示されます。被疑薬、併用薬、相互作用の三種類があります。
過去においては医薬品連番の”1”が第1被疑薬を、医薬品連番の”2”が第2被疑薬示すというルールがありましたが、最近になって無くなりました。第2被疑薬も含めて被疑薬という括りになっています。「使用理由」に記載される症状名には用語の統一のため、ICH国際医薬用語集日本語版(MedDRA/J)に収載されている用語(Preferred Term:基本語)が用いられています。
・「医薬品名(販売名)」
医薬品(販売名)は、少し前までは”第1被疑薬に限り、分かる範囲でのみ製品名が記載されている”という内容でしたが、
Readmeを見ると「異常所見がその医薬品によるものと疑われるとして報告された医薬品名が一般名/販売名の順番で表示」とあるので、
”被疑薬で販売名まで判明している場合は記載あり”という内容に変わっているようです。
『疑われるものとして報告された医薬品名』が、被疑薬設定以外にも副作用報告されている症例レポートの場合は投与されている薬剤”全て”を指すのであれば、今後販売名も記載が増えてくるのかと思います。複数薬剤が投与されている限りはどの薬剤由来で異常所見が出たのかを判断するのは難しい、ということを考えれば症例レポート記載の薬剤全てに販売名が記載あるようになれば望ましいかと思いますが、まずは被疑薬の場合は販売名まで分かると理解していればよいかと思います。
販売名まで記載があれば、例えばジェネリックとの比較などで副反応の発生比較なども調査できるかと思います。・「投与開始日・投与終了日」
最近になって研究報告が増えてきたWeiBull解析を用いた薬剤因果関係調査に用いられます。
WeiBull解析では、横軸は時間、タテ軸は発生確率密度を設定して分析します。従来、工場で用いられる機械の稼働期間と故障発生割合を見て、故障確率密度によって、機械の不信頼度(耐用年数なども背景として)を求める際に使われていました。これにより保全計画を策定しています。
薬剤副作用解析研究においては、投与日から終了日まで(あるいは、「有害事象発生日」まで)の期間をくすりの曝露期間として、期間を時間単位に変換します。・「使用理由」
使用理由は薬剤一つひとつに記載があります。1つの医薬品に対し複数の使用理由があれば、セミコロン区切りで並べて表示されることもあります。原疾患とは異なることに注意が必要です。たとえば、結腸癌患者の場合、原疾患は”結腸癌”です。抗癌剤が投与され、副作用として「意識変容状態」が報告された場合は、『副作用:意識変容状態』『第1被疑薬:フルオロウラシル(使用理由:結腸癌)』とありますが、この患者さんがインフルエンザにかかってタミフルを処方されていた場合は、症例レポートには被疑薬リストに『オセルタミビルリン酸塩(使用理由:インフルエンザ)』と書かれています。更に嘔吐対策としてラモセトロン塩酸塩が処方されていれば『併用薬としてラモセトロン塩酸塩(使用理由:嘔吐)』と記載があります。・「医薬品の処置」には、「投与中止、減量、増量、投与量変更せず、不明、非該当」が記載されています。
「投与中止」には、休薬の場合が含まれます。
「投与量変更せず」には、投与量が不明であるものの投与が継続されている場合が含まれます。
「非該当」には、患者が死亡した場合や、副作用/有害事象の発現前に投与が終了した場合が含まれます。・「再投与による再発の有無」には、
『被疑薬が再投与された際に、副作用/有害事象が再発した場合は「副作用/有害事象名(有)」、再発しなかった場合は「副作用/有害事象名(無)」』と記載があります。
再投与したが副作用/有害事象が再度起こったかどうか分からない場合は「副作用/有害事象名(不明)」、再投与しておらず、副作用/有害事象の再発には該当しない場合は「副作用/有害事象名(再投与なし)」と表示されます。
複数の副作用/有害事象があれば、セミコロン区切りで並べて表示されます。
空欄の場合は、再投与が行われなかった場合、又は再投与の有無が不明の場合を示します。・「リスク区分等」
被疑薬が要指導医薬品に該当する場合には「要指導医薬品」と表示され、一般用医薬品の場合には該当するリスク区分が表示されます。薬剤テーブル サンプル
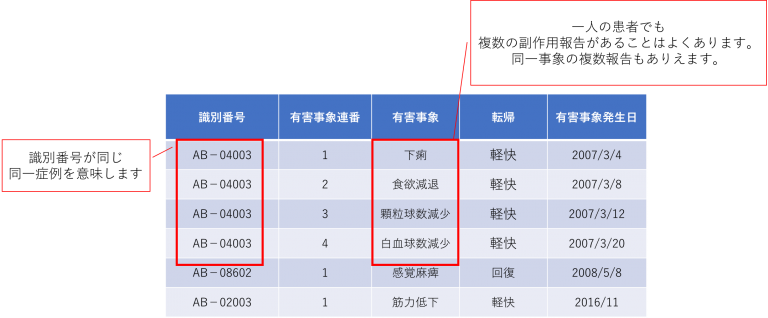
(3)副作用テーブル reacテーブルについて
・「転帰は_、「死亡、不明 、未回復 、回復(後) (回復したが後遺症あり)、軽快、回復、− (報告書が空欄の場合)」の表記があります。
・「有害事象の発現日」は8桁表記(:年月日時(CCYYMMDDhh))に限らず、4桁(年(CCYY))や、19桁(年月日時分秒.ミリ秒(CCYYMMDDhhmmss.UUUU))までありますので解析時には注意が必要です。
副作用テーブル サンプル
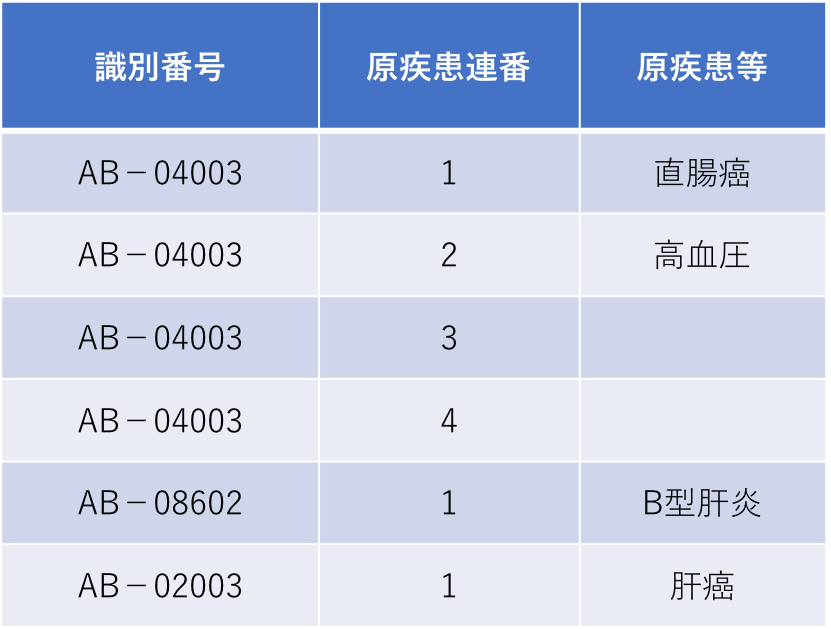
(4)原疾患テーブル histテーブルについて

原疾患テーブルサンプル
用語について
JADER・FAERSに限らず、ICH参加国における有害事象/副作用収集データベースにおいては副作用用語はMedDRAを統一基準として用いています。ということで、シグナル検出の情報源として自発報告データベースを扱い、解析する場合にはPTを用いるが一般的です。
製薬企業の市販後調査もPT(LLTも)にて用語統一しているケースが多いかと思います。
ただし、添付文書やRMPに用いられている用語とは異なりますので、FAERS/JADERからシグナル検出した副作用と、添付文書に記載記載の副作用を比較したい場合は、用語を網羅的にマッピングすることが必要となります。JADER報告のPT副作用が一見添付文書にはなく未知のものだと判定されても、似た表現で記載があればそれは未知ではなく、既知の副作用となるからです。この取りこぼしがないようにマッピング可能な辞書を用いることが重要になってきます。例えばJADER/FAERSにおいてシグナル検出した副作用が添付文書上にあるのかを確認したいような場合、(この選別を既知未知スクリーニングと言いますが、)マッピング技術等も含めて弊社メンバーが学会にて発表していますので、ご興味あるかたはお問合わせください。また、公開データがどのMedDRAバージョンを用いているのかを確認することが重要です。
通常は半期に一度MedDRAのバージョンは更新されます。
PMDA内において、キュレーション時には最新版を用いて整理しているようですので、
JADERの公開時にはどのバージョンを採用しているのかを確認してから、
解析者の手元にあるバージョンと公開データで合わせる必要があります。その他注意事項について
◆報告年度の四半期について
【JADERの場合】
報告をPMDAが受理した年度を示します。例えば、2011年4月に受理した場合、2011・第一、2014年3月に受理した場合、2013・第四と表示されます。
第1四半期は4月〜6月、第2四半期は7月〜9月、第3四半期は10月〜12月、第4四半期は1月〜3月 となります。
2014年3月受理が2013年・第4四半期となることには注意が必要です。また、2012年10月公開分より、報告年度・四半期のデータ仕様が変更になっています。
2012年9月分以前は、製薬企業がPMDAに報告した日でした。
2012年10月以降は、PMDAが製薬企業から報告書を受付けた日となっています。
2012年9月分以前のデータと内容を比較検討される際は、ご注意ください。【FAERSの場合】
四半期の期間がJADERとは異なります。
第1四半期は1月〜3月、第2四半期は4月〜6月、第3四半期は7月〜9月、第4四半期は10月〜12月 です。例えば日米両国でほぼ同時に販売が開始されたものを比較する時や、それぞれで販売開始時期から一定期間を定めての解析をする場合は
この期間設定を考慮のうえ分析することになります。◆同一症例重複について
同一の症例が複数の報告者から、それぞれ報告されることがあります。
マニュアルに記載されいてる例ですと、文献情報等において、販売名等が特定されず一般名のみが判明している場合には、その一般名の医薬品を製造販売している製造販売業者等が自社の製品として報告する必要があり、該当する製造販売業者等が複数存在する場合には、それぞれの製造販売業者から同一の症例が重複して報告されることがあるようです。
また、対象症例が判明すれば統合されるでしょうが、医療機関からも報告があれば重複となる可能性があります。JADERとFARESの違いについて
細かいところを挙げるときりがないので主なところを下記します。
1)テーブルの数・種類
JADERに比較してFAERSはテーブルの種類が多いです。FAERSでは「Therapy」「Outcome」「Report_Sources」が更に存在します。この種類の多さゆえ、同じ薬剤テーブルでもその記載内容が異なります。2)薬剤テーブル記載内容
JADERの場合はその薬剤の投与日、投与終了日を薬剤テーブルに記載していますが、
FAERSの場合は、Therapyに記載しています。また、薬剤の役割についてFAERSでは第1被疑薬(PS)・第2被疑薬(SS)と細かく記載されています。
(JADERは被疑薬のみ)併用薬の記載は双方ともあります。3)副作用/有害事象発現日について
JADERでは副作用情報テーブルに「有害事象の発生日」が有害事象毎に記載されています。
FAERSの場合は、症例情報(Demo)テーブルにdate情報として種々の発生日が書いています。
・event日:通常の副作用発生日。ただし、副作用毎には記載がされていません。
・mfr日:製薬企業へ報告された日
・fda日:FDAへ報告された日
等
どの日付を副作用発現日とするのかは解析者に委ねられています。4)患者情報記載内容
JADERでは上記したとおり、プライバシーを重視して年齢・体重・身長は丸めて記載されています。
FDAERSでは、そのままを記載されています。
年齢は、0.5歳や、10ヶ月、69歳や、400日など記載ルールもまちまちです。解析者泣かせですね。
体重もポンドや、kgも混ざって入っています。身長はありません。5)四半期の定義
上述したとおりです。1月〜3月の取扱いに注意です。6)主キーと副キーの存在
JADERは主キーが一つしかないので、重複選別が難しいですが、
FAERSの場合、主キー以外にCASEIDという副キーがありますので、
同症例を複数回に渡って報告しているという症例を見つけ出すことができます。
この場合、最新版のみを採用することで重複削除が可能です。他、やはり記載内容の粒度・正確さについてはJADERはきれいなデータであると言ってもよいほど整っています。
FAERSの場合は記載内容の少なさや、ミスの多さ、統一の取れなさが目立ちます。
ボリュームは多いのですが、結果として解析対象として使うための量があるかどうかは、
目的変数を毎回確認しなければならないかと思います。まとめ
前回は紐解くのが難解なFAERSを挙げながらDB構造の概念を中心に説明しました。
今回は紐解きやすいJADERを例に、細かいところまで説明しました。
順番としてはどちらが先でも構いませんので、ご自身の利用目的や解析として何が可能なのかなどを
頭に入れながら両方とも確認頂ければと思います。・JADERとFAERSは似ているDB構造を持っている
・だが記載内容やテーブルには違いがあるので比較する際には注意が必要★どんな解析ができるのかを注目してDB構成を理解する
★医療DBは他にもDPCやレセプト等あるが、基本モデルは同じ
各テーブルの記載内容(フィールド・カラム)として、どこに注目するのかを解析目的に合わせて注意、準備しておく今後のテーマ
・医療DBを対象として各種研究報告の内容紹介
・シグナル解析とは
自発報告データベースにおけるシグナル検出
・解析手法について
各指標、ロジスティック分析等を考えています。
-
お問合わせ
メルマガ登録




