通常PVPにおけるシグナル管理(5) ~アクション4 海外のデータを確認~
-
シグナル管理に関する投稿5回目です。
架空のケース設定内容糖尿病治療薬である「インテージック」について、2021年12月に2件の「間質性肺疾患」の追加報告がありました。
この報告を受けて、安全対策をとるべきかどうかの判断を行いたいと考えています。
アクション1~7をもとにシグナル検証・評価をおこなし、安全対策の要否を検討、判断します。
薬剤:インテージック(仮名) DPP4阻害薬
有害事象報告:間質性肺疾患今回はシグナル評価ステップにおけるアクションの4つ目をご紹介します。
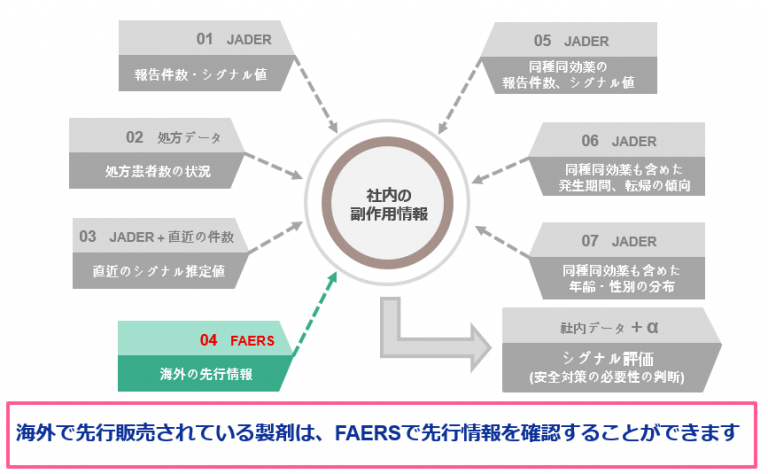
アクション4 海外データ(FAERS)における状況を確認
海外で販売されている医薬品については、FAERSで状況確認ができるため、
FAERSにおける報告件数・シグナルの状況を確認します。[方法]
CzeekV Proを用いて確認します。CzeekV で検索 (JADERを検索した後にタブ切替)
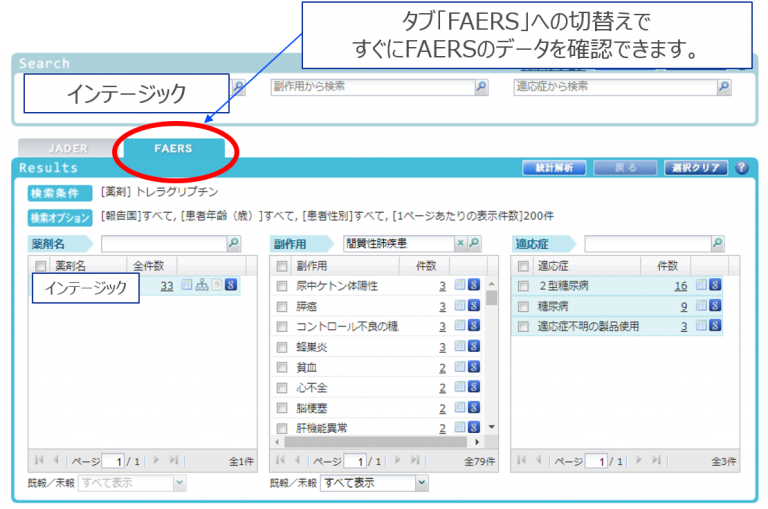
結果
CzeekV Proではタブの切替のみでJADER←→FAERSを閲覧できるようにしております。
最初にデータを選択してから検索するか、
検索後にJADERの結果から表示をタブ切り替えでFAERSとするかの違いとなります。FAERSでは症例報告は 33 件ありました。
ただし、副作用名”間質性肺疾患”にて絞り込んでも副作用一覧では抽出できません。どうやら
FAERSにおける症例報告の中では
間質性肺疾患のイベントはなさそうです。症例の詳細を確認してみます。
症例を確認するには
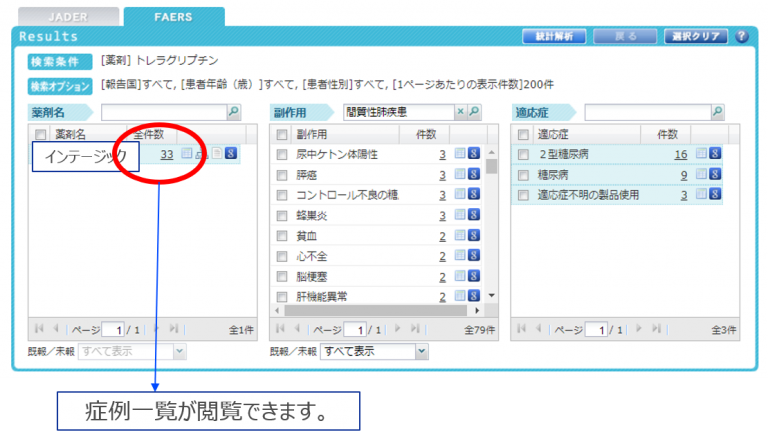
CzeekV Proでは検索結果の症例報告数数”数値”をクリックすることで
(上図でいうと 33件)
症例一覧を開くことができます。
この症例一覧を見てみると抗糖尿病薬であるインテージテック(仮名)を投与され、有害事象イベントがあったと
FDAに報告された症例はすべて日本での報告でした。
ただし、他薬剤併用による報告もあったりするため、JADERでの報告分は含まれていないようです。
また、FAERSの報告症例にはイベント”間質性肺疾患”はありませんでした。以上から、海外での結果は今回のケースでは無いということとなりました。
引き続きJADERを活用して類薬での確認を進めていきたいと思います。
次稿にて報告いたします。(補足1)FDA FAERSについて
「FAERSにはJADERのデータとの重複はないの?」と聞かれることがしばしばあります。
FDAにおける副作用報告ルールの一つは下記となります。・米国と海外(米国からみて海外)の両方で発売されている薬剤で、海外で発症した有害事象症例もFDAに報告すること
よって、日本でJADERに含まれる症例レポートと同じものがFAERSに含まれることはあります。
一方で、JADERは重篤な副作用に絞り込まれているという特徴がありますので
製薬企業の方から見て、自身が報告したものがFAERSには搭載してあり、JADERには見当たらないということもあり得るかと思われます。また、併用薬情報も登録されるので、調査において自身が把握していない症例報告がSRSデータには含まれる可能性があることも
注意しておくことの一つです。タグ: -
お問合わせ
メルマガ登録




